KORONAVIROVÝ SPECIÁL: S vakcínami se spěchalo, splňují ale veškeré bezpečnostní standardy
11.02.2021Nemám pochyb o tom, že vakcíny jsou nezbytným nástrojem pro zvládnutí pandemie koronaviru. V následujícím seriálu se detailněji podíváme nejen na dodavatelský řetězec, ale také odpovíme na otázky, které v souvislosti s vakcínami proti viru SARS-CoV-2 padají.
Počáteční problémy s dodávkami vakcín se snad podařilo vyřešit. Podívejme se na to, jaké druhy vakcín proti koronaviru máme k dispozici, jak jednotlivé vakcíny v našem těle fungují a proč bylo možné vyvinout je v tak rekordním čase – a také jak rychle jsme teoreticky schopni dosáhnout žádané proočkovanosti.
Jednou z nejčastějších výtek směrem k vakcínám proti novému typu koronaviru je ta, že byly vyvinuty v „podezřele“ krátkém čase. Je však nutné si uvědomit, že s vývojem vakcíny proti SARS-CoV-2 vědci nezačínali od nuly. Jak již oficiální název viru napovídá, patří do celé rodiny koronavirů, které se v minulosti běžně vyskytovaly i na našem území. Většinou způsobovaly pouze běžné nachlazení bez vážnějších příznaků. Ale patří mezi ně také podtypy SARS a MERS, které způsobily rozsáhlé epidemie se stovkami obětí v roce 2002 a 2012. Také díky těmto předchozím zkušenostem už vědci věděli, na které části viru se při vývoji vakcíny zaměřit, a jakmile Čína v lednu loňského roku zveřejnila genetickou informaci viru, vrhli se do práce.
Vzhledem k celosvětovému dopadu šíření nového typu koronaviru se na vývoj vakcíny také soustředily stovky špičkových vědeckých týmů; vývoji vakcíny byl věnován bezprecedentní objem peněz i lidských zdrojů. Pro urychlení výzkumu a uvedení vakcíny do praxe byly také přizpůsobeny některé administrativní a politické procesy tak, aby nikde nedocházelo ke zbytečným zdržením a zároveň aby nebyl žádným způsobem osekán klinický výzkum – pouze bylo umožněno, aby všechny tři fáze testování účinnosti, bezpečnosti a případných nežádoucích účinků proběhly naráz. Testování se účastnily desítky tisíc dobrovolníků z různých částí světa, což je při vývoji vakcín standardní počet.
Vývoj technologií, které vědci nyní uplatnili, také nejsou úplnou novinkou. S jejich výzkumem se začalo již v letech 2013–2016 při reakci na epidemii Eboly, která poukázala na to, jak málo jsme na infekční nákazy připraveni. Dalo by se to přirovnat ke složkám Integrovaného záchranného systému: s výstavbou požární zbrojnice a pořízením hasičských vozů také nečekáme až na chvíli, než někde začne hořet, ale máme je pro všechny případy připraveny v pohotovosti. Když pak někde opravdu vypukne požár, jsou hasiči schopni efektivně zasáhnout v řádu minut. Díky univerzální technologii vyvinuté při epidemii Eboly bylo možné celý proces vývoje nové vakcíny výrazně zkrátit.
Než je možné jakýkoliv léčivý přípravek – včetně vakcíny – uvést na trh, je také samozřejmě potřeba, aby vedle klinických testů prošel schvalovacím procesem. Zcela zásadní roli při schvalování vakcín v Evropské unii hraje Evropská agentura pro léčivé přípravky (EMA). Je to nezávislý odborný regulační orgán, jehož hlavní zodpovědností je, aby léčivé přípravky byly řádně otestované a bezpečné. V případě vakcín proti nemoci covid-19 je udělována tzv. podmíněná registrace, která platí pouze jeden rok. Podmíněnost registrace spočívá v tom, že firmy musí i po uvedení vakcíny na trh dále dodávat podrobná data ohledně bezpečnosti, účinnosti a kvality látek, ze kterých jsou vakcíny vyráběny. Cílem je také kontrola toho, že má jejich používání stále více přínosů než rizik, tedy že opravdu chrání před nákazou. Institut podmíněné registrace EMA použila již několikrát – před pandemií koronaviru naposledy v roce 2019 pro již zmíněnou vakcínu proti Ebole.
Srovnání běžného a zrychleného procesu schvalování naleznete v této infografice.
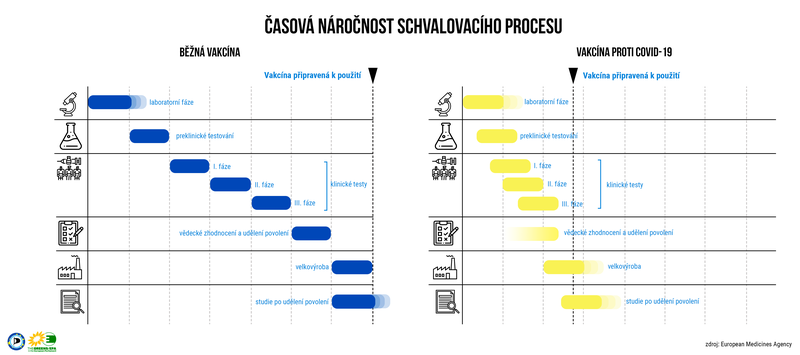
V souvislosti s koronavirem přijala EMA také několik výjimečných opatření, kterými se snaží zvýšit transparentnost celého procesu schvalování vakcín a léků proti covid-19, například bezodkladným zveřejňováním všech informací o postupech a nově schválených vakcínách na jednom místě.
Zrychlené testování a registrace vakcín má také svá úskalí – nebylo například možné jejich účinnost a bezpečnost zatím otestovat u dětí a mladistvých, v případě vakcíny AstraZeneca chybí také dostatečná data pro lidi nad 65 let. I proto EMA tyto vakcíny schválila pouze pro očkování věkových skupin, pro které měla k dispozici dostatek dat z klinických testů.
Jak je snad z předchozího textu patrné, Evropská unie má k dispozici robustní procesy, díky nimž je zajištěno, že námi používané vakcíny jsou bezpečné a účinné. Jakékoliv politické tlaky na EMA kvůli dalšímu urychlení procesu, jak to naznačil např. Andrej Babiš v případě vakcíny Sputnik V (jejíž výrobce si mimochodem o registraci u EMA dosud nezažádal), jsou tak naprosto nežádoucí. Pokud by se Česká republika rozhodla jít cestou nouzového schválení vakcíny bez registrace u evropského regulátora, byl by to nezodpovědný hazard s lidskými životy.

Více o druzích vakcín a o tom, jak fungují, se dozvíte v další části mého vakcinačního seriálu.